Химический элемент Содержание История становления понятия | Известные химические элементы | Классификация | Символы химических элементов | Распространённость химических элементов в природе | Образование | Химические элементы как составная часть химических веществ | См. также | Ссылки | Примечания | Литература | НавигацияБедняков В. А. «О происхождении химических элементов» Э. Ч. А. Я., Том 33 (2002), Часть 4 стр.914-963.Значение слова "Элементы химические" в Большой Советской ЭнциклопедииАрхивированоАтомы и химические элементыКлассы неорганических веществDiscovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118Кругосвет — Элементы химическиеРоберт Бойль и возникновение научной химии / Левченков С. И. Краткий очерк истории химииХимическая революция / Левченков С. И. Краткий очерк истории химииОсновные понятия химии“Evidence for a long-lived superheavy nucleus with atomic mass number A=292 and atomic number Z=~122 in natural Th”В космических лучах нашли сверхтяжелые элементыDetection of Plutonium-244 in Nature10.1038/234132a0Handbook of elemental speciation II: species in the environment, food, medicine & occupational health«Хаббл» открыл первую килоновуАрхивированоПростые и сложные вещества. Аллотропия. Названия сложных веществисториякопия
Химические элементыОсновные положения и определения в химии
атомовзарядомпротоноватомному номерунейтроновИЮПАКтаблице Периодической системы элементовМенделееваабстрактные объектылат.античностиЦицерономОвидиемГорациемРобертом БойлемкорпускулАнтуан Лоран ЛавуазьекислородазотводородсерафосфоругольсветтеплородкальциямагнияэмпирикоатомахмолекулахДжону Дальтонуатомно-молекулярная гипотезаатомный весЙёнса Берцелиусамеждународном съезде химиковКарлсруэмолекулыПериодического законаД. И. Менделеевымпериодический характер изменения свойств химических элементовклассификациинейтроновизотоповкосмических лучей3Heзарядом ядраГенри МозлиДжеймса Чедвика2016 годаостальныеядерных реакцийтрансурановых элементовунбиквадийунбинилийунбигексийэкатория-унбибия (122)торияатомными числамиострова стабильностиРасширенная периодическая таблица элементовзахвата нейтроновальфа-частицамиМеждународный союз теоретической и прикладной химииангл.систематическим названиемсанскритскиегерманийкремниемпредсказанный Менделеевымоганесонрадономфлеровийсвинцоммедьсереброжелезозолотортуть1814 годуЯ. БерцелиусомВременные символыПериодической таблицеземной корекислородкремнийалюминийжелезокальцийнатрийкалиймагнийводородтитанкислородаводородахлорнатриймагнийсеракалийбромуглеродкларковым числомкоре ЗемлимантииядраСолнечной системеВселеннойводородгелийизотоповнуклеосинтезаземной коретехнецийпрометийастатнептунийплутонийбета-распаденуклеосинтезеГалактикеСолнечной системытехнецийпрометийполонийастатрадонфранцийрадийактинийпротактинийнептунийплутонийпериодической системе Д. И. Менделеевавзрывов сверхновыхПериоды полураспадаизотоповвременем существования Землиприродных сверхтяжёлых элементовзвёздного нуклеосинтезабета-распаделитийбериллийборпервичный нуклеосинтезнейтронных звёздХимические веществапростое веществосложное веществохимическое соединениеаллотропиейозоналмазграфитдругих аллотропных модификацийуглеродагазообразныхHHeNOFNeClArKrXeRnжидкостиBrHgтвёрдые тела
Химический элемент
Перейти к навигации
Перейти к поиску
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным[1]. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева[2].
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)[3]. Необходимо различать химические элементы (абстрактные объекты, описываемые через свои характеристики) и соответствующие им материальные объекты — простые вещества (обладающие определёнными физико-химическими свойствами)[4].
По состоянию на 2016 год известно 118[5] химических элементов. 94 из них встречаются в природе (некоторые лишь в микроколичествах), а остальные 24 искусственно синтезированы.
Содержание
1 История становления понятия
2 Известные химические элементы
3 Классификация
4 Символы химических элементов
5 Распространённость химических элементов в природе
6 Образование
7 Химические элементы как составная часть химических веществ
8 См. также
9 Ссылки
10 Примечания
11 Литература
История становления понятия |
Слово «элемент» (лат. elementum) использовалось ещё в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).[6]
Близкое к современному пониманию понятие химического элемента отражала новая система химической философии, изложенная Робертом Бойлем в книге «Химик-скептик» (1661). Бойль указал, что ни четыре стихии Аристотеля, ни три принципа алхимиков не могут быть признаны в качестве элементов. Элементы, согласно Бойлю — практически неразложимые тела (вещества), состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних[7].

Символы химических элементов по Дж. Дальтону: 1 — водород; 2 — магний; 3 — кислород; 4 — сера; 5 — аммиак; 6 — диоксид углерода.
В 1789 г. Антуан Лоран Лавуазье в «Элементарном курсе химии», приводит первый в истории новой химии список химических элементов (таблицу простых тел), разделённых на несколько типов. Он впервые отождествляет с химическими элементами ряд простых веществ (в их числе, кислород, азот, водород, сера, фосфор, уголь и все известные к тому времени металлы). В число элементов были включены свет, теплород и «солеобразующие землистые вещества» (трудноразлагаемые оксиды кальция, магния и др.). Данную концепцию элементов принято называть эмпирико-аналитической, поскольку Лавуазье избрал критерием определения элемента опыт и только опыт, категорически отвергая любые неэмпирические рассуждения об атомах и молекулах, само существование которых невозможно подтвердить экспериментально[8].
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йёнса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Ко времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, которые придают им известную совокупность физических и химических свойств». Открытие Менделеева позволило предвидеть существование, а также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Однако Менделеев был вынужден сделать несколько перестановок в последовательности элементов, распределённой по возрастающему атомному весу, чтобы соблюсти периодичность химических свойств, а также ввести незаполненные клетки, соответствующие неоткрытым элементам. Позднее (в первые десятилетия XX века) стало ясно, что периодичность химических свойств зависит от атомного номера (заряда атомного ядра), а не от атомной массы элемента. Последняя определяется количеством стабильных изотопов элемента и их природной распространённостью. Тем не менее, устойчивые изотопы элемента имеют атомные массы, группирующиеся около некоторого значения, поскольку изотопы с избытком или недостатком нейтронов в ядре нестабильны, причём с ростом числа протонов (то есть атомного номера) число нейтронов, формирующих в совокупности стабильное ядро, также растёт. Поэтому периодический закон может быть сформулирован и как зависимость химических свойств от атомной массы, хотя эта зависимость нарушается в нескольких случаях.
С открытием изотопов стало ясно, что даже различные совокупности атомов одного и того же элемента могут иметь различающиеся атомные массы; так, радиогенный гелий, выделенный из урановых минералов, в связи с преобладанием изотопа 4He имеет атомную массу больше, чем гелий космических лучей (где присутствует также лёгкий изотоп 3He).
Современное понимание химического элемента как совокупности атомов, характеризующихся одинаковым положительным зарядом ядра, равным номеру элемента в Периодической таблице, появилось благодаря фундаментальным работам Генри Мозли (1915) и Джеймса Чедвика (1920)[9].
Известные химические элементы |
На декабрь 2016 года известно 118 химических элементов (с порядковыми номерами с 1 по 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные 24 получены искусственно в результате ядерных реакций. Предпринимаются попытки синтеза следующих сверхтяжёлых трансурановых элементов, в том числе были заявления о синтезе элемента унбиквадий (124) и косвенные свидетельства об элементах унбинилий (120) и унбигексий (126), которые пока не подтверждены. Также было объявлено об обнаружении элемента экатория-унбибия (122) в образцах природного тория[10], однако это заявление впоследствии не подтверждено на основании последующих попыток воспроизведения данных с использованием более точных методов. Кроме того, есть сообщения об открытии в метеоритном веществе следов столкновений с частицами с атомными числами от 105 до 130, что может являться косвенным доказательством существования стабильных сверхтяжёлых ядер[11]. Поиски сверхтяжёлых трансурановых элементов в природе, возможных согласно теории острова стабильности, пока не увенчались достоверным успехом, а синтезирование новых трансурановых элементов продолжается в российском, американских, немецком и японском центрах ядерных исследований силами международных коллективов учёных. Информация об ещё не открытых химических элементах доступна в статье Расширенная периодическая таблица элементов.
Синтез новых (не обнаруженных в природе) элементов, имеющих атомный номер выше, чем у урана (трансурановых элементов), осуществлялся вначале с помощью многократного захвата нейтронов ядрами урана в условиях интенсивного нейтронного потока в ядерных реакторах и ещё более интенсивного — в условиях ядерного (термоядерного) взрыва. Последующая цепочка бета-распадов нейтроноизбыточных ядер приводит к росту атомного номера и появлению дочерних ядер с атомным номером Z > 92. Таким образом были открыты нептуний (Z = 93), плутоний (94), америций (95), берклий (97), эйнштейний (99) и фермий (100). Кюрий (96) и калифорний (98) также могут быть синтезированы (и практически получаются) этим путём, однако открыты они были первоначально с помощью облучения плутония и кюрия альфа-частицами на ускорителе. Более тяжёлые элементы, начиная с менделевия (101), получаются только на ускорителях, при облучении актиноидных мишеней лёгкими ионами.
Право предложить название новому химическому элементу предоставляется первооткрывателям. Однако это название должно удовлетворять определённым правилам. Сообщение о новом открытии проверяется в течение нескольких лет независимыми лабораториями, и, в случае подтверждения, Международный союз теоретической и прикладной химии (ИЮПАК; англ. International Union for Pure and Applied Chemistry, IUPAC) официально утверждает название нового элемента.
Все известные на декабрь 2016 года 118 элементов имеют утверждённые ИЮПАК постоянные названия. От момента заявки на открытие до утверждения названия ИЮПАК элемент фигурирует под временным систематическим названием, производным от латинских числительных, образующих цифры в атомном номере элемента, и обозначается трёхбуквенным временным символом, образованным от первых букв этих числительных. Например, 118-й элемент, оганесон, до официального утверждения постоянного названия носил временное название унуноктий и символ Uuo.
Неоткрытые или неутверждённые элементы часто называются с помощью системы, использованной ещё Менделеевым, — по названию вышестоящего гомолога в периодической таблице, с добавлением префиксов «эка-» или (редко) «дви-», означающих санскритские числительные «один» и «два» (в зависимости от того, на 1 или 2 периода выше находится гомолог). Например, до открытия германий (стоящий в периодической таблице под кремнием и предсказанный Менделеевым) назывался эка-кремнием, оганесон (унуноктий, 118) называется также эка-радоном, а флеровий (унунквадий, 114) — эка-свинцом.
Классификация |
Этот раздел статьи ещё не написан. |
Символы химических элементов |
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1814 году шведским химиком Я. Берцелиусом. Временные символы элементов, использующиеся до официального утверждения их постоянных названий и символов, состоят из трёх букв, означающих латинские названия трёх цифр в десятичной записи их атомного номера (например, унуноктий — 118-й элемент — имел временное обозначение Uuo). Используется также система обозначений по вышестоящим гомологам, описанная выше (Eka-Rn, Eka-Pb и т. п.).
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле[9]:
| атомная масса | заряд иона | |
| Символ элемента | ||
|---|---|---|
| порядковый номер | число атомов в молекуле |
Примеры:
H2displaystyle mathsf H_2 — молекула водорода, состоящая из двух атомов водорода
Cu2+displaystyle mathsf Cu^2+ — ион меди с зарядом 2+
612Cdisplaystyle mathsf ^12_6C — атом углерода с зарядом ядра, равным 6 и атомной массой, равной 12.
В Периодической таблице карточка химического элемента обычно включает следующие характеристики:
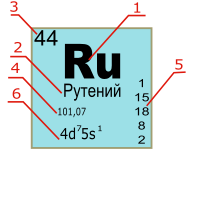
1 — обозначение химического элемента.
2 — русское название.
3 — порядковый номер химического элемента, равный количеству протонов в атомном ядре.
4 — атомная масса: среднее значение атомной массы устойчивых изотопов в земной коре или атомная масса наиболее долгоживущего изотопа (для радиоактивных элементов).
5 — распределение электронов по энергетическим уровням.
6 — электронная конфигурация.
Распространённость химических элементов в природе |

Распространённость химических элементов в земной коре (% масс.) — кларковые числа
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Массовое содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Образование |
Большинство химических элементов (94 из известных 118) были найдены в природе (в земной коре), хотя некоторые из них были вначале получены искусственно (а именно: технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85), а также трансурановые нептуний Np (93) и плутоний Pu (94); эти пять элементов после их искусственного создания были в исчезающе малых количествах обнаружены и в природе; они возникают как промежуточные ядра при радиоактивном распаде урана и тория, а также при захвате ураном нейтронов и последующем бета-распаде). Таким образом, в земной коре наличествуют (в очень разных концентрациях) все первые 94 элемента таблицы Менделеева.
Среди этих 94 химических элементов, обнаруженных в земной коре, большинство (83) является первичными, или примордиальными; они возникли при нуклеосинтезе в Галактике до образования Солнечной системы, и у этих элементов есть изотопы, которые являются либо стабильными, либо достаточно долгоживущими, чтобы не распасться за прошедшие с этого момента 4,567 млрд лет. Остальные 11 природных элементов (технеций, прометий, полоний, астат, радон, франций, радий, актиний, протактиний, нептуний и плутоний) являются радиогенными — они не имеют настолько долгоживущих изотопов, поэтому все существующие в земной коре природные атомы этих элементов возникли при радиоактивном распаде других элементов[12][13].
Все элементы, следующие после плутония Pu (порядковый номер 94) в периодической системе Д. И. Менделеева, в земной коре полностью отсутствуют[14], хотя некоторые из них могут образовываться в космосе во время взрывов сверхновых[источник не указан 2089 дней]. Периоды полураспада всех известных изотопов этих элементов малы по сравнению с временем существования Земли. Многолетние поиски гипотетических природных сверхтяжёлых элементов пока не дали результатов.
Большинство химических элементов, кроме нескольких самых лёгких, возникли во Вселенной главным образом в ходе звёздного нуклеосинтеза (элементы до железа — в результате термоядерного синтеза, более тяжёлые элементы — при последовательном захвате нейтронов ядрами атомов и последующем бета-распаде, а также в ряде других ядерных реакций). Легчайшие элементы (водород и гелий — почти полностью, литий, бериллий и бор — частично) образовались в первые три минуты после Большого взрыва (первичный нуклеосинтез).
Одним из главных источников особо тяжёлых элементов во Вселенной должны быть, согласно расчётам, слияния нейтронных звёзд, с выбросом значительных количеств этих элементов, которые впоследствии участвуют в образовании новых звёзд и их планет.[15]
Химические элементы как составная часть химических веществ |
Химические вещества могут состоять как из одного химического элемента (простое вещество), так и из разных (сложное вещество или химическое соединение).
Химические элементы образуют около 500 простых веществ[16]. Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией.[16] В большинстве случаев названия простых веществ совпадают с названием соответствующих элементов (например, цинк, алюминий, хлор), однако в случае существования нескольких аллотропных модификаций названия простого вещества и элемента могут отличаться, например кислород (дикислород, O2) и озон (O3); алмаз, графит и ряд других аллотропных модификаций углерода существуют наряду с аморфными формами углерода.
В обычных условиях 11 элементов существуют в виде газообразных простых веществ (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 — жидкости (Br и Hg), остальные элементы образуют твёрдые тела.
См. также |
- Список химических элементов
- Хронология открытия химических элементов
- Периодическая система химических элементов
- Нуклид
- Изотоп
- Элементарная частица
- Система частиц
Ссылки |
Кедров Б. M. Эволюция понятия элемента в химии. M., 1956- Химия и Жизнь (Солтеровская химия). Ч.1. Понятия химии. М.: Изд-во РХТУ им. Д. И. Менделеева, 1997
Азимов А. Краткая история химии. СПб, Амфора, 2002- Бедняков В. А. «О происхождении химических элементов» Э. Ч. А. Я., Том 33 (2002), Часть 4 стр.914-963.
Примечания |
↑ Коллектив авторов. Значение слова "Элементы химические" в Большой Советской Энциклопедии (неопр.). Советская энциклопедия. Архивировано 16 мая 2014 года.
↑ Атомы и химические элементы.
↑ Классы неорганических веществ.
↑ Чернобельская Г.М., Методика обучения химии, 2000, с. 266—267.
↑ Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 (неопр.).
↑ Кругосвет — Элементы химические
↑ Роберт Бойль и возникновение научной химии / Левченков С. И. Краткий очерк истории химии
↑ Химическая революция / Левченков С. И. Краткий очерк истории химии.
↑ 12 Основные понятия химии.
↑ Marinov, A.; Rodushkin, I.; Kolb, D.; Pape, A.; Kashiv, Y.; Brandt, R.; Gentry, R. V.; Miller, H. W. (2008). “Evidence for a long-lived superheavy nucleus with atomic mass number A=292 and atomic number Z=~122 in natural Th”. ArXiv.org. Проверено 2008-04-28. Используется устаревший параметр|coauthors=(справка).mw-parser-output cite.citationfont-style:inherit.mw-parser-output qquotes:"""""""'""'".mw-parser-output code.cs1-codecolor:inherit;background:inherit;border:inherit;padding:inherit.mw-parser-output .cs1-lock-free abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-limited a,.mw-parser-output .cs1-lock-registration abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-subscription abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registrationcolor:#555.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration spanborder-bottom:1px dotted;cursor:help.mw-parser-output .cs1-hidden-errordisplay:none;font-size:100%.mw-parser-output .cs1-visible-errorfont-size:100%.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-formatfont-size:95%.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-leftpadding-left:0.2em.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-rightpadding-right:0.2em
↑ В космических лучах нашли сверхтяжелые элементы // Lenta.ru. — 2011.
↑ За исключением следов примордиального плутония-244, имеющего период полураспада 80 млн лет; см. Плутоний#Природный плутоний.
↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature (англ.) // Nature : статья. — 1971. — Iss. 234. — P. 132—134. — DOI:10.1038/234132a0.
↑ Rita Cornelis, Joe Caruso, Helen Crews, Klaus Heumann. Handbook of elemental speciation II: species in the environment, food, medicine & occupational health. — John Wiley and Sons, 2005. — 768 с. — ISBN 0470855983, 9780470855980.
↑ «Хаббл» открыл первую килонову Архивировано 8 августа 2013 года. // compulenta.computerra.ru
↑ 12 Простые и сложные вещества. Аллотропия. Названия сложных веществ (недоступная ссылка с 21-05-2013 [2149 дней] — история, копия).
Литература |
- Менделеев Д. И.,. Элементы химические // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Чернобельская Г.М. Методика обучения химии в средней школе. — М.: Гуманитарный издательский центр ВЛАДОС, 2000. — 336 с. — ISBN 5-691-00492-1.
Категории:
- Химические элементы
- Основные положения и определения в химии
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.616","walltime":"0.864","ppvisitednodes":"value":7171,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":139378,"limit":2097152,"templateargumentsize":"value":22179,"limit":2097152,"expansiondepth":"value":25,"limit":40,"expensivefunctioncount":"value":4,"limit":500,"unstrip-depth":"value":1,"limit":20,"unstrip-size":"value":12605,"limit":5000000,"entityaccesscount":"value":1,"limit":400,"timingprofile":["100.00% 689.951 1 -total"," 34.66% 239.134 1 Шаблон:Примечания"," 20.70% 142.842 1 Шаблон:Нет_АИ"," 20.04% 138.287 1 Шаблон:Надстрочное_предупреждение"," 19.51% 134.600 1 Шаблон:Видимый_якорь"," 13.46% 92.882 1 Шаблон:Сортировка:_статьи_без_источников"," 13.43% 92.656 2 Шаблон:Статья"," 11.47% 79.103 1 Шаблон:Cite_journal"," 11.42% 78.813 5 Шаблон:Другое_значение"," 10.86% 74.936 1 Шаблон:Сортировка:_по_типам"],"scribunto":"limitreport-timeusage":"value":"0.165","limit":"10.000","limitreport-memusage":"value":4141813,"limit":52428800,"cachereport":"origin":"mw1333","timestamp":"20190409040706","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u0425u0438u043cu0438u0447u0435u0441u043au0438u0439 u044du043bu0435u043cu0435u043du0442","url":"https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82","sameAs":"http://www.wikidata.org/entity/Q11344","mainEntity":"http://www.wikidata.org/entity/Q11344","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"u0424u043eu043du0434 u0412u0438u043au0438u043cu0435u0434u0438u0430","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2005-01-25T19:03:06Z","dateModified":"2019-03-01T14:20:51Z","headline":"u0441u043eu0432u043eu043au0443u043fu043du043eu0441u0442u044c u0430u0442u043eu043cu043eu0432 u0441 u043eu0434u0438u043du0430u043au043eu0432u044bu043c u0437u0430u0440u044fu0434u043eu043c u044fu0434u0440u0430 u0438 u0447u0438u0441u043bu043eu043c u043fu0440u043eu0442u043eu043du043eu0432, u0441u043eu0432u043fu0430u0434u0430u044eu0449u0438u043c u0441 u043fu043eu0440u044fu0434u043au043eu0432u044bu043c (u0430u0442u043eu043cu043du044bu043c) u043du043eu043cu0435u0440u043eu043c u0432 u0442u0430u0431u043bu0438u0446u0435 u041cu0435u043du0434u0435u043bu0435u0435u0432u0430"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":163,"wgHostname":"mw1261"););


